הוא התגבר על יתמות, עוני ובריאות לקויה בדרך למציאת השיטה לסידור היסודות הכימיים. 150 שנה לטבלה המחזורית ו-185 שנה להולדת מפתחהּ, דמיטרי מנדלייב
לרשימת כל הכתבות הקוליות באתר
כבר לפני אלפי שנים הכירה האנושות כמה יסודות חשובים כמו נחושת, ברזל, כסף וזהב. אך רשימת היסודות המוכרים נשארה כמעט בלי שינוי מימי השושלות הקדומות של מצרים העתיקה, עד עידן הזוהר של הכימיה באמצע המאה ה-18, אז התגלו בזה אחר זה עוד ועוד יסודות, בהם חמצן, חנקן וכלור. כשהכימאי הצרפתי אנטואן לבואזיה ערך ב-1789 את רשימת היסודות המעודכנת היא כבר כללה 33 חומרים – כפליים ויותר מהיסודות שהיו מוכרים יובל שנים קודם לכן. בתוך כמה עשורים שוב הוכפלה הרשימה, ובאמצע המאה ה-19 היא כבר כללה כ-60 יסודות שונים.
על אף הקצב המסחרר של הגילויים, ואולי בגללו, שרר באותן שנים כאוס מוחלט במדע הכימיה. הכימאים עדיין לא הבינו את משמעותו של "יסוד". הרשימה של לבואזיה, למשל, כללה נוסף על יסודות אמיתיים גם את האור ואת החוֹם (שנחשב אז לחומר בשם "קָלוֹרִיק"). רוב המדענים שללו את הרעיון שהחומר מורכב מאטומים, ונסמכו על הכלל הפשוט שקבע לבואזייה כי יסוד הוא חומר שאי אפשר לפרקו לחומרים אחרים בתגובה כימית. למרות הבלבול וחוסר הבהירות, הידע שהצטבר על היסודות השונים ותכונותיהם כבר היה כה רב, שמישהו היה צריך לעשות בו סדר. למצוא את ההיגיון שיאפשר להבין את הקשרים בין היסודות השונים, ואולי גם את מהות החומרים עצמם.
מדענים רבים ניסו למצוא דרך לארגן את רשימת היסודות באופן שישקף את התכונות השונות שלהם. כמה וכמה חוקרים פיתחו סידורים שונים המתכתבים פחות או יותר עם העקרונות העומדים כיום בבסיסו של המיון המוכר לנו. אבל כשהתפזר ערפל הקרב על פריצת הדרך המדעית הזו, ניצב מעל כולם חוקר אחד ויחיד ששמו קשור היום באופן בלעדי כמעט ללוח המשבצות המוכר לכל בוגר חטיבת ביניים – הטבלה המחזורית של היסודות.
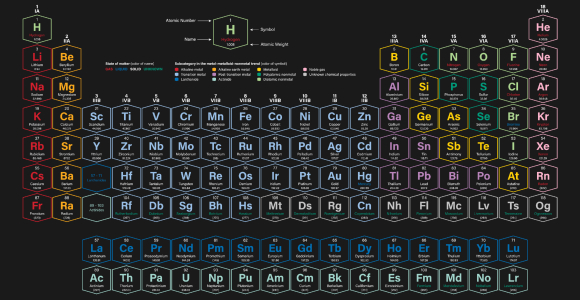
יצירת מופת מדעית המשקפת תכונות רבות של היסודות השונים. הטבלה המחזורית של היסודות | מקור: Shutterstock
זכוכית שרופה
דמיטרי איבנוביץ' מנדלייב (Mendeleev, או ליתר דיוק Менделе́ев) נולד ב-8 בפברואר 1834 בכפר קטן ליד העיר טובולסק שבסיביר. הוא היה הצעיר מ-14 ילדיו של מנהל בית ספר מקומי, אך כשהיה ילד איבד אביו את מאור עיניו ולא היה יכול להמשיך בעבודתו. האם, מריה, נטלה על עצמה את פרנסת המשפחה, ופתחה מחדש בית חרושת לזכוכית שהיה שייך למשפחתה. כשהיה דמיטרי בן 13 מת האב, וכעבור כמה חודשים נשרף בית החרושת. מריה דמיטרייבנה, שרוב ילדיה הבוגרים כבר עמדו ברשות עצמם, החליטה להשליך את יהבה על כישוריו של הבן הצעיר ביותר, ולהעניק לו חינוך טוב ככל האפשר.
האם ובנה יצאו על סוסים למסע של אלפי קילומטרים מערבה, דרך הרי אורל, עד מוסקבה, אך אוניברסיטת מוסקבה היוקרתית סירבה לקבל את מנדלייב ללימודים בנימוק שאינו תושב העיר. השניים רכבו עוד כמה מאות קילומטרים לסנקט פטרבורג, בירת רוסיה בימים ההם. גם שם הוא לא התקבל לאוניברסיטה, משום שהיה כפרי מסיביר וחסר אמצעים. בסופו של דבר הצליחה האם לרשום את בנה לסמינר למורים שבו למד אביו בשעתו. כמה שבועות אחר-כך היא הלכה לעולמה, ודמיטרי הצעיר נותר לבדו, להגשים את משאלתה של אמו ולהצליח בלימודים.
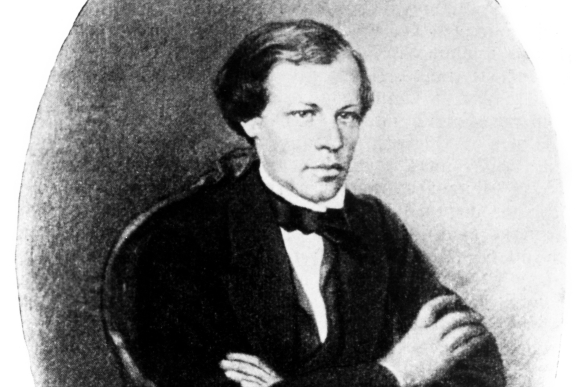
תלמיד מצטיין וחוקר מבטיח, למרות המצוקה הכלכלית. מנדלייב בשנות ה-20 לחייו | מקור: Science Photo Library
חובות וספרים
מנדלייב אכן היה תלמיד מצטיין, וכבר במהלך לימודי ההוראה עסק במחקר בכימיה והתחיל לפרסם מאמרים. בסיום לימודיו חלה בשחפת, ובעקבות זאת נסע לעבוד בחצי האי קרים, בתקווה שהאקלים הנוח יותר יסייע לו להתאושש. הוא לימד שם בבית ספר תיכון במשך שנתיים, ואז שב לסנקט פטרבורג, למרות שלא חיכתה לו שם משרה קבועה. הוא היה שקוע בחובות כספיים ועסק בכל עבודה שנקרתה בדרכו: לימד בבתי ספר, הדריך סטודנטים במעבדות, נתן שיעורים פרטיים ואפילו כתב ידיעות על מחקרים בכימיה לביטאון של משרד החינוך הרוסי. כעבור שנתיים זכה במִלגה שאיפשרה לו לצאת להשתלם בפריז ובהיידלברג שבגרמניה. שם הוא עבד אצל הכימאי הנודע רוברט בונזן (Bunsen) ובין השאר התמחה בספקטרוסקופיה – תחום מחקר חדש יחסית אז. בבסיסו של מדע הספקטרוסקופיה עומדת העובדה שכל יסוד מגיב באופן שונה לאור שמוקרן עליו: בולע אורכי גל מסוימים ופולט אחרים. בחינה שיטתית של יסוד מסוים באורכי גל שונים מאפשרת לזהות את החתימה האופטית שלו, ובאופן דומה הקרנה של חומר לא ידוע מאפשרת לפענח מאילו יסודות הוא מורכב על פי הדפוס שבו הוא פולט או בולע גלי אור.
כששב לסנקט פטרבורג ב-1861 מונה מנדלייב למרצה לכימיה בסמינר למורים. הוא הוטרד מרמתם הנמוכה של לימודי הכימיה ברוסיה לעומת מה שראה בגרמניה, וגם מהעדרם של ספרי לימוד טובים ברוסית. בגיל 27 הוא חיבר בתוך חודשיים ספר לימוד מקיף בכימיה. הספר זכה בפרס חשוב (פרס דמידוב) והקנה למנדלייב הכרה בקהילה המדעית בארצו. לא פחות חשוב, הפרס הכספי איפשר לו לפרוע כמעט את כל חובותיו. פרסומו עזר לו להתמנות למרצה באוניברסיטת סנקט פטרבורג, עוד לפני שסיים את לימודי הדוקטורט שלו. רק כעבור שנה, ב-1865, קיבל תואר דוקטור על מחקרו שעסק בתגובות בין חומרים אלכוהוליים למים.
מנדלייב החל לעבוד על עוד ספר לימוד חשוב, "עקרונות הכימיה", שיצא לאור בסופו של דבר ב-1869, ובמקביל החל לעסוק בשאלה המדעית שתלווה אותו בשנים הבאות ותקנה לו תהילת עולם: סידור שיטתי של היסודות הכימיים.

מעבר בין גרסאות - מהגרסה המודקדמת של מנדלייב לטבלה המחזורית המודרנית | איור: Science Photo Library
מחזוריות לא הגיונית
כשמנדלייב היה בהיידלברג הוא פגש את הכימאי האיטלקי סטניסלאו קניצארו (Canizzaro), שפרסם ב-1860 רשימה של המשקלים האטומיים של היסודות ביחס למשקלו של המימן. בעקבות הפרסום הזה הבחינו עוד מדענים במחזוריות במשקלים האטומיים של היסודות, ואף גילו קשר בין המחזוריות הזו לכמה תכונות אחרות של היסודות, כמו המשקל הסגולי (צפיפות החומר), נקודת הרתיחה והנטייה ליצור תרכובות עם חומרים אחרים.
בין המדענים שגילו זאת בנפרד היו הגיאולוג הצרפתי אלכסנדר דה-שנקורטואה (Chancourtois) והכימאי האנגלי ג'ון ניולנדס (Newlands). עבודתו של שנקורטואה זכתה להתעלמות כללית, ככל הנראה משום שלא הצליח להסביר את רעיונותיו בצורה ברורה. ניולנדס, לעומתו, הציג סיווג מעניין של היסודות לשמונה קבוצות, אך הרעיון נחשב "שנוי במחלוקת" בעיני האגודה המדעית החשובה של ימיו, "החברה המלכותית", והיא סירבה לפרסם את מחקריו. ויליאם אודלינג (Odling) האנגלי הגיע גם הוא לטבלה דומה, אבל הפיתוח שלו לא זכה לפרסום דווקא משום שהוא מילא תפקיד בכיר בחברה המלכותית, והתעורר חשד כי ניצל את מעמדו לטרפד את הפרסום של ניולנדס. הכימאי הגרמני גוסטבוס הינריכס (Hinrichs) פנה לגישה אחרת וניסה, ללא הצלחה, לפתח סידור של היסודות המחזוריים על בסיס אלגברי. סידור מוצלח יותר עשה גרמני אחר, לותר מאייר (Meyer), אך כפי שהוא עצמו הודה, הוא לא העז לפרסם את עבודתו מחשש שתתקבל בלעג.

השראה חלומית. הגרסה של הטבלה מ-1871, עם מקומות ריקים וכמה תחזיות | מקור: Science photo Library
מחלום למציאות
בניגוד לכמה מקודמיו, מנדלייב היה כימאי מנוסה מאוד בעבודת מעבדה. הוא לא רק קרא על היסודות בספרי הלימוד אלא הכיר את רובם מקרוב, מה שהקנה לו ידע מוצק מאוד על תכונותיהם. כדי לנסות להתאים ביתר קלות בין המשקל האטומי לתכונות היסוד הוא הכין לעצמו מעין קלפים, שעל כל אחד מהם פרטיו של אחד מ-63 היסודות שהיו מוכרים אז. מנדלייב נהג לשחק עם הקלפים שלו משחק דמוי "סוליטר", ולנסות לסדר אותם באופן הגיוני. כמה ימים לאחר יום הולדתו ה-35, נרדם בערב על השולחן תוך כדי משחק. "בחלומי ראיתי טבלה שבה כל יסוד היה במקום המתאים לו. כשהתעוררתי, מיד כתבתי לי את הדברים", כתב לימים.
כדי להגשים את החלום, הבין מנדלייב שעליו לעשות כמה שינויים שמדענים אחרים שללו על הסף. הוא החליף למשל את מקומותיהם של הטלוריום והיוד: אף שהטלוריום מעט יותר כבד, הוא החליט לשבץ את היוד במקומו, בדיוק מתחת לברום, הדומה ליוד בכמה תכונות.
על מנת להשלים את הסידור על פי העקרון הזה, תכונות דומות של יסודות, נאלץ מנדלייב להשאיר מקומות ריקים בטבלה - לא היו יסודות שתכונותיהם תאמו את התכונות הצפויות משוכני המקומות האלה. באומץ, ואולי בחוצפה, הוא טען שהיסודות המתאימים עוד יתגלו, ואף ניבא מה יהיו תכונותיהם הפיזיקליות והכימיות.
מנדלייב חזה למשל את קיומו של אטום בעל תכונות כימיות דומות לאלה של סיליקון (צורן) אך כבד ממנו, שיהיה ממוקם מתחתיו בטבלה המחזורית. הוא קרא לו "אֶקָא-סיליקון", על בסיס מילה בסנסקריט שפירושה "מעֵבֵר ל-". אֶקָא-סיליקון, חזה מנדלייב, יהיה חומר בעל משקל אטומי 72 (כלומר – פי 72 ממימן), ומשקל סגולי של כ-5.5 גרם לסמ"ק. הוא העריך שזו תהיה מתכת קלה בעלת נקודת רתיחה נמוכה יחסית, וכי היא תוכל להיקשר לשני אטומי חמצן, או לחילופין לארבעה אטומי מימן או ארבעה אטומי כלור. באופן דומה הוא חזה יסודות נוספים: אֶקָא-אלומיניום ואֶקָא-בורון.

הטבלה המחזורית האפילה על תרומתו גם לתחומים רבים אחרים במדע. מנדלייב | מקור: Science Photo Library
התחזית מתממשת
מנדלייב פרסם את הטבלה המחזורית שלו ב-1869, ובפרסום נוסף, ב-1871, כלל טבלה מדויקת יותר ובה הציע את התחזיות שלו ליסודות החסרים. כמו כל חידוש מדעי, גם את הטבלה של מנדלייב – ובמיוחד את התחזיות שלו – קיבלו חוקרים רבים בספקנות, במיוחד לאחר שמדענים כה רבים לא הצליחו להתמודד עם האתגר.
בתוך שנים בודדות, דעת הקהל השתנתה. ב-1875 עסק הכימאי הצרפתי לֶקוֹק דה בּוּאַבּוֹדְרַן (De Boisbaudran) בחקר מינרלים עשירים באבץ וזיהה בהם יסוד לא מוכר. הוא שיער שגילה יסוד חדש והחל לקבוע את תכונותיו, עד שהמפרט נראה מוכר לאחד מעמיתיו. חיפוש קצר העלה את המאמר שפרסם מנדלייב ארבע שנים קודם לכן, ועד מהרה התברר שהיסוד החדש אינו אלא האֶקָא-אלומיניום. החוקר הצרפתי העניק לו שם חדש, גָלְיוּם, לכבוד שמה הקדום של ארצו – גאליה. ארבע שנים לאחר מכן הסיפור חזר על עצמו כמעט במדויק – הפעם היה זה כימאי שבדי, לארס נילסון (Nilson), שגילה את האֶקָא-בורון, וקרא לו סקנדיום – על שם סקנדינביה. ב-1886 הגיע תורו של הכימאי הגרמני קלמנס וינקלר (Winkler) שגילה יסוד המתאים בדיוק לתחזית של אֶקָא-סיליקון, וגם הוא קרא לו על שם ארצו – גרמניום.
עד מהרה היה ברור לכל כי הטבלה המחזורית של מנדלייב היא הדרך הטובה ביותר לסדר את היסודות. גם יסודות שלא היו מוכרים בעת הכנת הטבלה השתבצו בה, ואפילו כשהתגלתה קבוצה שלמה של יסודות – הגזים האצילים – נמצא לכולם מקום בעמודה חדשה בצד ימין של הטבלה המחזורית. עם השנים, כשהמדע התקדם ליצירת יסודות מלאכותיים, גם הם שובצו בטבלה על פי המאפיינים שלהם.

סידור הפרוטונים, הניטרונים והאלקטרונים אחראי לסידור הטבלה המחזורית. מבנה האטום | איור: Science Photo Library
סידור פנימי
עם התקדמות הכימיה והפיזיקה, וההבנה כיצד בנוי האטום, התברר גם מדוע הסידור של מנדלייב היה כה מוצלח, ומה הקשר בינו לבין מגוון התכונות של האטומים. אנו יודעים כיום כי גרעין האטום מורכב מפרוטונים בעלי מטען חשמלי חיובי ומניטרונים, חלקיקים כמעט זהים אך חסרי מטען. האלקטרונים שמקיפים את הגרעין הם בעלי מטען שלילי, המאזן את הפרוטונים מבחינה חשמלית, אבל המסה שלהם כה קטנה עד שהיא זניחה ביחס לגרעין.
מספר הפרוטונים באטום הוא שמבדיל בין יסוד ליסוד. בגרעין של אטום מימן יש רק פרוטון אחד, לכן משקלו האטומי הוא 1. בגרעין של אטום חנקן יש שבעה פרוטונים – לכן מספר האטומי 7, וגם שבעה ניטרונים, לכן משקלו האטומי הוא 14 – כמו 14 אטומי מימן. בגרעין של אטום זהב יש 79 פרוטונים (ולכן זה מספרו האטומי), ו-118 ניטרונים, לכן משקלו האטומי 197.
האלקטרונים מסודרים סביב הגרעין בשכבות, קצת כמו הקליפות של הבצל. הקליפה הפנימית ביותר יכולה להכיל רק שני אלקטרונים, לכן השורה העליונה בטבלה כוללת רק שני יסודות – מימן, שיש לו אלקטרון אחד, והליום, בעל שני אלקטרונים. בקליפה השנייה יש מקום לשמונה אלקטרונים, כך שהיסוד הראשון בשורה השנייה, הליתיום, הוא בעל קליפה פנימית מלאה, ואלקטרון בודד בקליפה השניה. לבריליום שבא אחריו יש שני אלקטרונים בקליפה השניה, וכן הלאה, עד לניאון, יסוד מספר 10, ששתי הקליפות שלו מלאות. בשורות הבאות נמצאים יסודות כבדים יותר ויותר, בעלי יותר ויותר קליפות.
המצב היציב ביותר עבור אטום הוא קליפה חיצונית מלאה. יסוד שהקליפה החיצונית שלו אינה מלאה יכול להגיע למצב הזה באמצעות מסירה או קבלה של אלקטרונים, או חיבור עם אטום אחר כך ששניהם יחלקו כמה אלקטרונים. מספר האלקטרונים החסרים בקליפה החיצונית קובע את הקשרים שהאטום יכול ליצור, ולכן רבות מתכונותיו הכימיות. מנדלייב סידר את הטבלה שלו כך שיסודות בעלי אותו מספר אלקטרונים בקליפה החיצונית נמצאים באותו טור, למרות שלא ידע דבר על מבנה האטום. התכונה הזו היא גם כמובן המקור לשלשות של דבריינר - ליתיום, נתרן ואשלגן כולם בעלי אלקטרון יחיד בקליפה החיצונית, לכן מגיבים באופן דומה.
כשמתבוננים בטבלה מודרנית רואים שהמשקל האטומי של רוב היסודות אינו כפולה מדויקת של משקל המימן, אלא בדרך-כלל מספר קרוב. זה נובע מקיומם של איזוטופים – צורות נוספות של אותו יסוד הנבדלות רק במספר הניטרונים, ולכן במשקל האטומי. במקרה של פחמן, למשל, כ-99 אחוז מהאטומים בטבע הם הפחמן ה"רגיל", בעל ששה פרוטונים וששה ניטרונים, ויש רק מעט איזוטופים אחרים, לכן משקלו האטומי הממוצע הוא 12.01. לעומת זאת, רק כ-72 אחוזים מאטומי הרובידיום בטבע הם האיזוטופ הרגיל, שמשקלו האטומי 85, וכמעט 28 אחוז הם איזוטופ כבד יותר, 87, לכן המשקל האטומי הממוצע של רובידיום הוא כמעט 85.5.
מבנה האטום והקשרים בין האטומים מסבירים תכונות נוספות רבות של החומרים, כמו מצב הצבירה, מוליכות חשמלית, מוליכות חום וכן הלאה.

תהילת עולם. בול דואר סובייטי מ-1969 לציון 100 שנה לטבלה המחזורית | מקור: ויקיפדיה, שימוש חופשי
מדען רב-תחומי
הצלחתה העצומה של הטבלה המחזורית הפכה את מנדלייב לאחד המדענים המוכרים ביותר בדורו, אך מצד שני האפילה על תרומות רבות אחרות שלו למדע. בין השאר הוא עסק רבות בפטרוכימיה – חקר הנפט ותוצריו. הוא היה ממקימי בתי הזיקוק הראשונים ברוסיה, וחקר ופיתח דלקים, דשנים וחומרי נפץ. כמו כן הוא עסק בחקר תכונות פיזיקליות של חומרים ושל מצבי צבירה, ובחן בין השאר סוגיות כמו הקשר בין טמפרטורה לנפח בחומרים שונים, ותכונות של תמיסות. חלק מנתיבי המחקר שלו היו שגויים – הוא למשל סבר בטעות כי האֶתֶר עשוי להיות יסוד נוסף, קל יותר מן המימן, בעל תכונות של גז.
לצד עבודתו המדעית עסק מנדלייב רבות בסוגיות כלכליות וחברתיות. הוא ייעץ לממשלת רוסיה בנושאי חקלאות והסכמי סחר, ופעל להגן על המשק הרוסי באמצעות מכס ומיסים על ייבוא. הוא גם היה מראשוני התומכים בהשכלה אקדמית לנשים וקידם פתיחת הרצאות וקורסים עבורן.
סיפור נחמד ממחיש את מעמדו הרם של מנדלייב ברוסיה. כשהתגרש מאשתו הוא רצה להתחתן מיד עם אישה אחרת (היא הייתה בת 19 והוא בן 43), בלי לחכות כמה שנים כשפי שדרשה הכנסייה, לכן שיחד כומר שיחתן אותו מייד. כשהדבר התגלה הכומר הודח, אך למנדלייב לא נעשה דבר. לפקיד שהתלונן על כך אמר הצאר "למנדלייב יש אמנם שתי נשים, אבל לי יש רק מנדלייב אחד". בין אם הסיפור נכון ובין אם לאו, ב-1891 הוא אולץ בכל זאת להתפטר מהאוניברסיטה בגלל תמיכתו הפוליטית בקבוצות סטודנטים קיצוניות.
הוא לא נשאר מחוסר עבודה, וזמן קצר לאחר מכן מונה לראש הלשכה למידות ומשקולות – מעין מכון תקנים. אגדה נוספת קושרת אותו לקביעת התקן של ריכוז האלכוהול בוודקה, 40 אחוז, אך ככל הידוע אין לה שום בסיס. מנדלייב גם הקים את האגודה הרוסית לכימיה, וקידם את השימוש בשיטה המטרית במדינה.
הוא זכה בפרסים מדעיים רבים, בהם מדליית קופלי והפרס היוקרתי על שם המפרי דייוי. ב-1905 וב-1906 היה מועמד לפרס נובל, אך הפסיד על חודו של קול. הוא לא הספיק להיות מועמד שוב. ב-2 בפברואר 1907 מת משפעת, ימים אחדים לפני יום הולדתו ה-73. בסופו של דבר הוא זכה לכבוד גדול עוד יותר – יסוד מספר 101 נקרא על שמו מנדלביום, וכך הוא הונצח בטבלה המחזורית שהוא עצמו פיתח.
סרטון TED-Ed על הגאוניות של הטבלה המחזורית (כתוביות בעברית):
