على الرّغم من عدم وضوح أسباب العمليّة التنكسيّة في الخلايا المنتجة للدوبامين، إلّا أنَّ المعرفة بمسار المرض تتطوّر باستمرار - وكذلك أدوات علاجه
ينعكس الارتفاع المستمرّ في مستوى المعيشة في البلدان المتقدّمة، وخاصة التطوّرات الهائلة التي حدثت في المعرفة الطبّيّة في القرن الماضي، بزيادة كبيرة في متوسّط العمر. لهذا التوجه المبارك أيضًا آثار جانبيّة مؤسفة: فكلّما زاد سنّ الشيخوخة، زاد خطر الإصابة بأمراض ليست شائعة بين المجموعات الأصغر سنًّا، والآن يجب إيجاد علاج لها.
من الأمثلة البارزة على ذلك، الأمراض التنكسيّة للجهاز العصبيّ. باستثناء مناطق معيّنة، لا تتجدّد الخلايا العصبيّة في دماغنا بشكل طبيعيّ. إذا ماتوا، أو تعطّلت وظائفهم بسبب مرض، فمن المحتمل أن نرى بمرور الوقت انخفاضًا في أداء المخ لوظيفته، الذي يؤدّي إلى ظهور أعراض تصعّب حياة من يعانون منها. تشمل هذه المجموعة من الأمراض، مرض الزهايمر المعروف بشكل أساسيّ بالضرر الذي يسبّبه لذاكرة من يعانون منه، مرض التصلّب الجانبيّ الضموريّ (ALS)، ومرض الشلل الارتعاشيّ (باركنسون).
ليس فقط مرض شيخوخة
يرتبط مرض باركنسون بشكل أساسيّ بالشيخوخة، ويزداد احتمال حدوثه مع تقدّم العمر. يصيب حوالي واحد في المائة من الأشخاص الذين تبلغ أعمارهم 60 عامًا أو أكثر، ويزيد انتشاره خمسة أضعاف فوق سن الـ-85. مع ذلك، يحتمل حدوثه أحيانًا في سن مبكّرة، وتمّ تشخيص حوالي 10 في المائة من مرضاه خلال عقدهم الثالث أو الرابع من الحياة. يُسمّى هذا النوع من مرض باركنسون بمرض باركنسون الشبابيّ.

يرتبط مرض باركنسون بشكل أساسيّ بالشيخوخة، لكنّه يصيب أيضًا الشباب في بعض الأحيان. امرأة تساعد مسنّ على النهوض | المصدر: ESB Professional، Shutterstock
أكثر السمات المعروفة لمرض باركنسون هي رعاش العضلات. كما يصاحبها أعراض أخرى مثل بطء الحركة، تيبُّس العضلات وصعوبة في الكلام. مع مرور الوقت، قد يعاني مرضى باركنسون أيضًا من صعوبة في النوم، مشاكل في البلع، الاكتئاب وصعوبة في مهارات التفكير في المراحل المتقدّمة.
المادّة السوداء
سبب هذه الأعراض هو موت الخلايا العصبيّة في منطقة من الدماغ تُعرف باسم "المادّة السوداء" (Substantia nigra). هذه الخلايا مسؤولة عن إنتاج الدوبامين - وهو أحد أكثر النواقل العصبيّة شيوعًا في الدماغ، أي، الجُزيْء الذي يسمح للخلايا العصبيّة بالتواصل مع بعضها البعض. يتم توزيع الدوبامين من خلايا المادة السوداء على أجزاء أخرى من الجهاز العصبيّ المركزيّ.
يلعب الدوبامين دورًا في مجموعة متنوّعة من الأنشطة الدماغيّة، بما في ذلك معالجة تجارب المتعة، المكافأة، الإدمان، الحركة والتفكير. الآلية العصبيّة التي تتأثر بشكل خاصّ بمرض باركنسون هي تلك المتعلّقة بالأداء الحركيّ للجسم.
يُعتقد أنَّ الأعراض الحركية لمرض باركنسون تعود لحقيقة أنَّ نقص الدوبامين يعطّل النشاط المنتظم للخلايا العصبية، في منطقة من الدماغ تسمّى العقد القاعديّة (Basal ganglia). هذه النّوى عبارة عن مجموعة من أجسام الخلايا العصبيّة الموجودة في عمق الدماغ، وتقوم بالتواصل الديناميكيّ فيما بينها. هذا التواصل، بدوره، مهمّ للعديد من وظائف الدماغ، مثل الذاكرة قصيرة المدى، اتخاذ القرارات، التحفيز والحركة.
يُفترض أيضًا أنَّ نقص الدوبامين الناتج في هذه المنطقة لدى مرضى باركنسون يؤدي إلى تعطيل عمل المهاد (Thalamus)، وهي منطقة دماغيّة أخرى تعمل كنوع من محطّة مركزيّة، تنظّم بعض تدفّق المعلومات بين أجزاء الدماغ. من بين الأمور، ينقل المهاد المعلومات الحسيّة والحركيّة إلى أجزاء من القشرة الدماغيّة المسؤولة عن الحركة، ويرسل تعليمات للعضلات حول الانقباض. عندما يضعف هذا الاتّصال، تتأخّر الحركة.
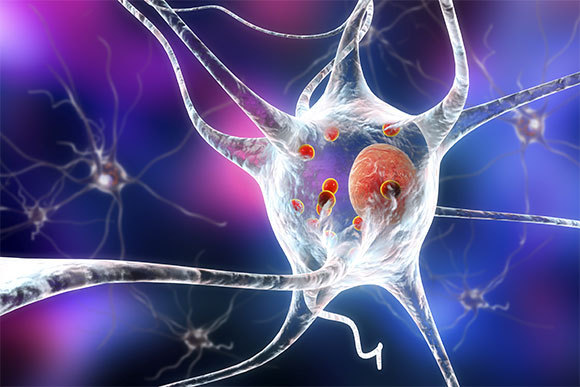
يتميّز المرض بتكوّن مجموعات من البروتينات مطويّة بشكل غير صحيح. "جسيمات ليوي" (كرات حمراء) داخل خليّة عصبيّة | رسم توضيحيّ: Kateryna Kon, Shutterstock
في المراحل المتقدّمة من المرض، يعاني الكثير من المرضى أيضًا من تدهور مهارات التفكير، لدرجة الإصابة بالخرف (Dementia). ترتبط هذه الظاهرة في مرضى باركنسون بتكوّن مجموعات بروتينية تسمّى "أجسام ليوي" (Lewy bodies) في الخلايا العصبيّة في الدماغ. تتكوّن أجسام ليوي من بروتينات مطويّة بشكل غير صحيح، وعلى رأسها بروتين ألفا- ساينوكلين (alpha-synuclein)، الذي يساعد عادةً في الاتّصال بين الخلايا العصبيّة، بل ويؤثّر على إنتاج الدوبامين وإطلاقه. قد يكون هذا الخرف مصحوبًا أيضًا بالهلوسة.
العلاج
العوامل المسبّبة لتنكّس الخلايا العصبيّة في المادّة السوداء ليست واضحة بما فيه الكفاية. من المعروف أنَّ الرجال يصابون بمرض باركنسون بمعدل أعلى قليلًا من النساء. كما من المعروف أنَّ للمرض مكوّنًا وراثيًّا، وهو ملحوظ بشكل خاصّ في المرضى الذين أصيبوا بالمرض في سنّ مبكرة. حوالي 15 في المائة من مرضى باركنسون لديهم قرب عائليّ لمريض آخر، ربّما بسبب طفرات مشتركة في جينات معيّنة. أحدها هو جين SNCA المنيج لبروتين ألفا سينوكلين. نظرًا لأنّه من المعروف أنَّ هذا البروتين مرتبط بتكوين أجسام ليوي، فمنّ المنطقيّ التكهّن بأنَّ خللًا في وظيفته بعد حدوث طفرة في الجين الذي يحتوي على تعليمات إنتاجه سيرتبط بمرض باركنسون، وهناك بالفعل دراسات تدعم هذه الفرضيّة.
على الرغم من عدم وجود طريقة لعلاج المرض حتّى يومنا هذا، إلّا أنَّ هناك العديد من العلاجات التي تساعد مرضى باركنسون على العمل بشكل جيّد، وتقليل مدى أعراضه الحركية. تعتمد العلاجات الدوائية على طرق مختلفة للتعويض عن نقص الدوبامين في الدماغ. الأدوية الأكثر شيوعًا هي تلك التي تعتمد على جزيئات ليفودوبا (L-Dopa أو Levodopa)، والتي تتحوّل إلى دوبامين في الدماغ. تحاكي الأدوية الأخرى عمل الدوبامين في الدماغ (ناهضات الدوبامين)، أو تؤخّر التفكّك الطبيعيّ للدوبامين الموجود، وبالتالي تطيل مدة فاعليّته (مثبطات MAO-B). يمكن أن يكون للأدوية آثار جانبية مزعجة، مثل الغثيان، تغيّرات سلوكيّة وحتّى الهلوسة.

يمكن أن يقلّل التحفيز الكهربائيّ المباشر للدماغ من بعض أعراض المرض. أقطاب كهربائيّة في دماغ مريض باركنسون | المصدر: Zephyr / Science Photo Library
المرضى الذين تكون حالتهم خطيرة، أو الذين لا ينجح العلاج في استقرار حالتهم، أو يتسبّب في آثار جانبيّة خطيرة لهم، قد يتمّ التفكير في منحهم علاجًا من خلال التحفيز العميق للدماغ (Deep brain stimulation). في هذا العلاج، يُغرَس في دماغ المريض أقطاب كهربائيّة تحفّز المناطق التي يكون نمط عملها غير كافٍ. يُعتبر هذا العلاج الجراحيّ فعّالًا في الحدّ من الأعراض الحركيّة التي تميّز المرض، ولكن ما زالت الآليّة الكامنة وراءه غير واضحة تمامًا. يبدو أنَّ التحفيز الكهربائيّ يثبط نشاط بعض الخلايا العصبيّة، في المنطقة التي تمّ غرسها فيها، وربّما يزيد أيضًا من نشاط الخلايا العصبيّة الأخرى.
بالإضافة إلى العلاجات الدوائيّة، يُوصى بشدّة أنّ يثابر مرضى باركنسون على ممارسة التمارين الرياضيّة اليوميّة الشاقّة. تشير الدراسات إلى أنَّ هذا النشاط مرتبط بإيقاف تطوّر المرض، وتقليل مدى أعراضه الحركيّة. تساهم التمارين بشكل عامّ أيضًا في تحسين الحالة المزاجيّة، وهو أمر مهمّ أيضًا لمرضى باركنسون، الذين قد يعانون من ضائقة نفسيّة بسبب حالتهم الصحّيّة. يجب اختيار النشاط الرياضيّ وتخطيطه وفقًا لخصائص مرض المريض.
بالإضافة إلى العلاجات المقدّمة لأولئك الذين أصيبوا بمرض باركنسون بالفعل، تُبذل الآن جهود كبيرة لتطوير لقاح لمرض باركنسون، والذي يمكن استخدامه كعلاج للمرضى، وربّما حتّى منع ظهور المرض أصلًا. تمّ تصميم هذا اللقاح، الموجود بالفعل في التجارب السريريّة الأوّليّة، لتدريب الجسم على التعامل مع مجموعات أجسام ألفا سينوكلين. من المفترض أن يقوم الجهاز المناعيّ بتعليم الجسم صنع أجسام مضادّة، تتعرّف على مثل هذه المجموعات وتساعد الدماغ على التخلّص منها، قبل أن تضعف وظيفتها. هذا نهج جديد نسبيًّا، وليس هناك ضمان من أنه سينضج في النهاية ليصبح لقاحًا عمليًّا. مع ذلك، إذا نجح هذا اللقاح في تخطّي جميع العقبات بسلام، فسنحصل لأوّل مرّة على لقاح لأمراض الدماغ التنكسيّة.
يتطوّر فهمنا لمرض باركنسون وطبيعته وظروف تطوّره بمرور الوقت، وتساهم في ذلك الأبحاث المتعدّدة حول هذا الموضوع. تعمل العلاجات الجديدة على تحسين مواجهته، ويتمّ تطوير عقاقير تجريبيّة جديدة باستمرار. على ضوء الزيادة في متوسّط العمر في زماننا، من المهم أكثر من أيّ وقت مضى مواصلة دراسته بعمق. مع تقدّم التكنولوجيا والطبّ، يواصل الباحثون فحص توجّهات جديدة، مثل اللقاحات. يُرجى أن يتحسّن الوضع في المستقبل أكثر، وأن نكون قادرين على التنبّؤ بشكل أفضل بتفشّي المرض وعلاجه، وربّما الشفاء منه أيضًا.
