קוטביות (פולאריות) של מולקולות ושל קשרים כימיים היא גודל חשוב בכימיה. הקוטביות קובעת את סוג הקשר הכימי – קוולנטי או יוני – ומשפיעה גם על אינטראקציות בין מולקולריות כמו קשרי המימן במים. היישומון שלפנינו מדגים מהי קוטביות של קשרים ומולקולות עם שניים או שלושה אטומים ואיך היא מושפעת מגודל שנקרא אלקטרו-שליליות שמאפיין כל אטום. בנוסף, היישומון מציג את הקוטביות של כמה מולקולות נפוצות. לצפייה ביישומון לחצו על התמונה ופתחו את הקובץ המקושר (יישומון ג'אווה).
היישומון הופק במסגרת פרויקט PhET של אוניברסיטת קולורדו
להורדת היישומון ולהרצתו על המחשב לחצו כאן
הפעם הבאנו לכם יישומון מתקדם יחסית, שמניח ידע מוקדם בכמה מושגי יסוד בכימיה. אז לפני שנתחיל, בואו נגדיר כמה מושגי יסוד החשובים לצורך הבנת היישומון והשימוש בו:
קשר כימי: צימוד שנוצר בין חלקיקים הבונים את החומר בעקבות כוח משיכה חזק ביניהם. יכולים להתקיים סוגים רבים של קישורים כימיים: קשר קוונלטי (שגם בו יש תת-סוגים), קשר יוני, מתכתי, וגם קשרים כימיים בין-מולקולריים: למשל קשרי מימן.
אם הנושא חדש לכם או אינו ברור מספיק, אתם מוזמנים לצפות בסרטון המסביר על הקשר הכימי.
קשר קוולנטי טהור: קשר כימי בין שני אטומים, שבו האטומים חולקים במידה שווה את האלקטרונים שמשתתפים בקשר. אף אטום בקשר הזה אינו טעון חשמלית באופן קבוע. השם באנגלית מורכב מהמילים וולאנס (valence – קליפה-אלקטרונית או ערכיות) וקו (שיתוף), כך שקשר קו-ולנטי הוא קשר של קליפה/ערכיות משותפת.
ראו כאן סרט הסבר על קשר קוולנטי.
קשר כימי יוני: קשר כימי שבו אלקטרון אחר או יותר שנמצא בקליפה החיצונית של אטום אחד עוזב את האטום ועובר "להסתובב" בקליפה של אטום אחר. כתוצאה ממעבר האלקטרון מאטום לאטום משתנה המטען החשמלי של האטומים (מאחר שהאלקטרון טעון מטען חשמלי שלילי) והם הופכים ליונים: האטום שמקבל אלקטרונים הופך ליון שלילי (אניון), והאטום שאיבד את אלקטרוניו הופך ליון טעון מטען חשמלי חיובי (קטיון) כי עזב אותו אלקטרון שלילי. לחצו כאן להרחבה על מה קובע אופי הקשר הכימי.
קוטביות (פולאריות) של מולקולות ושל קשרים כימיים: גודל שמבטא את המידה שבה המטען החשמלי מפוזר סביב חלקיקי החומר. חשיבותו של הגודל הזה טמונה בכך שהוא זה הקובע סוג הקשר הכימי: האם יהיה זה קשר קוולנטי טהור, קשר יוני טהור, קשר קוולנטי קוטבי וכו'.
כפי שאפשר לראות בהסבר הקצרצר שהבאנו על סוגי הקשרים הכימיים, האלקטרונים ומידת השיתוף או המעבר שלהם בין אטומים הם הדבר המגדיר סוגים רבים של קשרים כימיים – וכיוון שלאלקטרונים יש מטען חשמלי שלילי, מידת הפיזור של המטען החשמלי היא גודל שמרמז למעשה על מידת הפיזור של האלקטרונים בקשרים הכימיים.
הקוטביות נקבעת על פי ההפרש בערכים של גודל בשם אלקטרושליליות שיש לכל אטום המשתתף בקשר. ככל שהאלקטרושליליות של אטום גדולה יותר, כך הוא נוטה יותר למשוך לעברו אלקטרונים. עוד על כך ראו בסרטון הסבר על אלקטרושליליות.
מולקולה שמכילה קשרים כימיים מקוטבים בסידור המרחבי הנכון (כפי שמודגם ביישומון) תהיה בעצמה בעלת דו-קוטב (בעלת דיפול חשמלי). דיפול חשמלי משפיע רבות על תכונות החומר (כמו נקודת היתוך ורתיחה, ועל המסיסות שלו (להרחבה קראו מה קובע מסיסות של חומרים) – מפני שהוא משפיע על הקשרים הבין-מולקולריים שבחומר. באופן כללי, ככל שהחומר יותר מקוטב חשמלית, כך כוחות המשיכה בין חלקיקיו יהיו חזקים יותר.
בחלון שנפתח ביישומון מוצג קשר בין שני אטומים. מומלץ לסמן V בחלון תצוגה בצד ימין כדי להציג את המטענים החלקיים על כל אטום ואת אופי הקשר הכימי. רואים שאטום B קצת יותר אלקטרו-שלילי מאטום A, ולכן מומנט הדיפול פונה לכיוונו (מציירים מומנט דיפול על ידי חץ הפונה מהקוטב החיובי לשלילי).
כעת שנו באמצעות הסרגל למעלה את האלקטרו-שליליות של אטום A עד שתהיה גדולה יותר מזו של אטום B. מה קורה למטענים החלקיים ומה קורה למומנט הדיפול? שנו את האלקטרו-שליליות של אטום B והסתכלו שוב על מומנט הדיפול, המטענים החלקיים וגם אופי הקשר, שמשתנה מקשר קוולנטי טהור לקשר יוני. אפשר גם לסמן V בהצגת פני השטח (צד ימין באמצע), ולראות איך "ענני האלקטרונים" סביב שני האטומים מתמלאים כפונקציה של האלקטרו-שליליות. אפשר גם להדליק שדה חשמלי (צד ימין למטה) ואז לכוון את האלקטרו-שליליות של אטום A לאמצע ולשחק עם האלקטרו-שליליות של אטום B. מה קורה למולקולה בשדה החשמלי כשהקטבים מתהפכים?
כעת נעבור ללשונית "שלושה אטומים" (המעבר נעשה בלחיצה על החלק העליון של היישומון). כדאי לסמן V בתצוגה על כל האפשרויות. הפעם נראה שהמולקולה איננה קווית, אלא יש להן צורה זוויתית, (למשל במולקולת מים), ולכן יש הבדל בין מומנט הדיפול של המולקולה עצמה (חץ צהוב) לבין מומנט הדיפול של כל קשר וקשר ובה (החצים השחורים). מומלץ לשחק באלקטרושליליות של כל אטום ולראות איך הוא משפיע על כיוון מומנט הדיפול של כל המולקולה (שמושג על ידי חיבור וקטורי, כלומר חיבור שמתחשב בגודל ובזווית של מומנטי הדיפול של כל קשר).
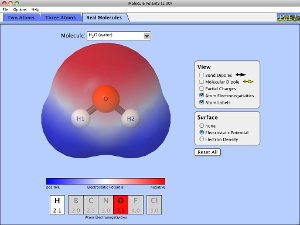
לבסוף עברו ללשונית "מולקולות אמיתיות". כאן תוכלו לבחור מולקולה ולהציג את כל המאפיינים שלה (מומלץ לסמן V בכל אפשרויות התצוגה). שימו לב שבמולקולות אמיתיות המצב "מסתבך", בגלל השוני בקשרים של האטום המרכזי והאטומים הקיצוניים או מפני שפיזור המטען חשמלי הפוך מהמצופה. כך יכול להתקיים מומנט דיפול במולקולה בעלת שלושה אטומים זהים, (כמו שקורה באוזון) או בין אטומים בעלי אלקטרו-שליליות קרובה. כך קורה למשל בפחמן ומימן – בהתאם לאטומים הקשורים לפחמן ולסוג הקשרים עמו.
שאלה למתקדמים: האם אתם יכולים להסביר מדוע למולקולה CF4 אין מומנט דיפול בכלל, אף על פי שכל קשר כימי בפני עצמו מקוטב (יש הפרש גבוה בהפרש האלקטרו-שליליות של פלואור ופחמן)?
ד"ר אבי סאייג
המחלקה לנוירוביולוגיה ומכון דוידסון לחינוך מדעי
מעון ויצמן למדע
הערה לגולשים
אם אתם חושבים שההסברים אינם ברורים מספיק או אם יש לכם שאלות הקשורות לנושא, אתם מוזמנים לכתוב על כך בפורום ואנו נתייחס להערותיכם. הצעות לשיפור וביקורת בונה יתקבלו תמיד בברכה.